深圳市血液中心药物临床试验机构成功备案
2021年3月4日,深圳市血液中心通过国家市场监督管理总局“药物临床试验机构备案管理信息平台”成功备案,继全国第一家血站系统“医疗器械临床试验机构”成功备案后,又成为全国血站系统第一家“药物临床试验机构”顺利备案机构,标志着深圳市血液中心同时具备了开展更多相关医疗器械/药物临床试验研究的平台和资质。
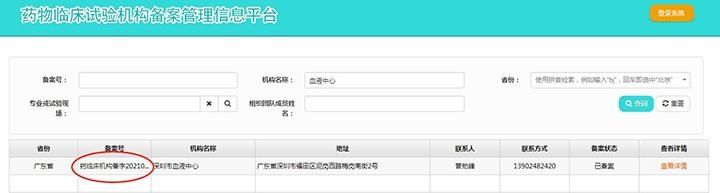
为贯彻落实《中华人民共和国药品管理法》(中华人民共和国主席令31号)《中华人民共和国疫苗管理法》(中华人民共和国主席令30号)要求,药物临床试验机构由资格认定调整为备案管理。2019年12月1日,随着《药物临床试验机构管理规定》(以下简称《规定》)的发布,“医疗器械临床试验机构备案管理信息系统”升级为“药物和医疗器械临床试验机构备案管理信息系统”,开放药物临床试验机构备案功能。
自2020年12月1日起,只有在备案系统完成备案的医疗机构、疾控机构方可开展临床试验。“管理办法”发布后,深圳市血液中心领导高度重视,成立中心药物临床试验机构筹备小组,组织相关部门学习研究相关政策法规。由检验科牵头,根据医疗器械临床试验机构备案的经验,严格按照备案要求逐项完善机构、伦理等相关制度,SOP(标准作业程序)及主要研究者相关材料,最终在2021年3月4日完成申报并通过了国家药监部门审核,成功备案。
由于我国血液筛查试剂是按照药品管理,此次成功备案,有力加强我中心临床试验工作及提升科学研究水平,有利于充分利用临床试验资源,推动血液筛查产品的临床试验评估工作,对血液筛查新技术、新方法的创新发展具有重大意义。
文/图 市血液中心 邬林枫、曾劲峰
【来源:深圳市卫生健康委员会】
声明:转载此文是出于传递更多信息之目的。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 邮箱地?/p>